一种快速检测梨火疫病菌活菌的方法及应用
商品类型
专利
专利号
CN111235236A
所属行业
资源与环境技术
归属方
新疆农业大学
上架日期
2020-07-14 23:17:49
交易方式
转让
交易价格
面议
详细介绍
[0001] 本发明属于农业生物技术领域,更具体的说是涉及一种快速检测梨火疫病菌活菌的方法及应用。
背景技术
[0002] 梨火疫病的病原菌为解淀粉欧文氏菌(Erwinia amylovora),是我国一类进境植物检疫危险性有害生物。其寄主范围广泛,侵染蔷薇科40多属220多种植物,其中危害最严重的是梨、苹果、山楂等仁果类果树。梨火疫病菌侵染花、叶片、嫩梢、幼果、枝条和树干,引起花腐、枯枝、果腐和整株死亡,严重时可以在一至几个生长季内将整个果园毁灭,造成严重的经济损失。迄今为止,梨火疫病安全有效的防控依然是世界性的难题。
[0003] 目前针对梨火疫病菌的检测方法大多采用常规的PCR、qPCR和诱捕PCR-ELISA等分子生物学检测技术。这些方法不仅能扩增活菌细胞DNA,也会扩增死菌细胞DNA以及游离状态的DNA分子,不能区分样品中病菌的存活状态,导致产生假阳性结果。利用半选择性培养基分离培养,依据菌落特征进行判断也是梨火疫病菌活菌鉴定的常用方法;但不同配方组成的半选择性培养基各有其优缺点,通常需要将2种或多种培养基结合使用,并辅以其他方法验证,存在耗时较长,易与形态相似的菌混淆等不足。
[0004] 因此,针对梨火疫病菌,特别是针对具有侵染力的活菌建立灵敏、精确、高效的快速检测方法,对于病害的早期诊断和检疫,制定科学防控措施有效阻断梨火疫病害传播扩散至关重要。
[0005] 有鉴于此,本发明提供了一种能适用于梨火疫病菌活菌的快速检测方法,可区分检测样品中病菌的存活状态,克服常规qPCR的假阳性,具有灵敏、准确、高效的特点。
[0006] 为了实现上述目的,本发明采用如下技术方案:
[0007] 一种快速检测梨火疫病菌活菌的方法,包括如下步骤:
[0008](1)制备样品悬浮液:
[0009] 使用无菌水对检测样品进行浸泡,吸取浸泡液,离心弃上清,加入无菌水重悬沉淀获得样品悬浮液;
[0010](2)PMA预处理样品悬浮液:
[0011] 避光条件下,向样品悬浮液中加入叠氮溴化丙锭,振荡孵育,孵育后在冰水浴中进行卤钨灯照射曝光,照射过程中进行振荡处理;
[0012](3)实时荧光定量PCR检测:
[0013] 以PMA预处理后的样品悬浮液作为模板,进行实时荧光定量PCR扩增;
[0014] 扩增引物为:
[0015] EaP29F1:5'-ATCCTCAGGGCAGCATCA-3',SEQ ID NO.1;
[0016] EaP29R1:5'-GGCAACGGCACCATCAGT-3',SEQ ID NO.2;
[0017](4)检测结果定性分析:
[0018] 根据实时荧光定量PCR的扩增曲线和获得的Ct值,确定检测样品中梨火疫病菌的存活状态;
[0019] 当检测样品Ct值<35,判定为阳性,即检测样品中含有梨火疫病菌活菌;当Ct值≥35,判定为阴性,即检测样品中不含有梨火疫病菌活菌。
[0020] 叠氮溴化丙锭(propidium monoazide,PMA)是一种光敏感的、与DNA高度亲和的染料,光解后能穿过死菌的细胞膜与DNA结合形成稳定的共价键,从而抑制死菌DNA扩增,而不会抑制细胞膜完整的活菌DNA扩增。将PMA与荧光定量PCR(qPCR)相结合的PMA-qPCR技术,仅以活菌DNA为扩增模板进行PCR扩增,实现对活菌的定量检测。目前PMA-qPCR技术主要是以纯菌菌体为检测样本,本发明检测方法中针对植株样品,不需提取其中的DNA,用样品浸泡液直接进行PMA-qPCR扩增,检测灵敏、准确的同时提高了检测速度,3-4小时即可完成整个检测过程。
[0021] 优选地,上述检测方法还包括对检测结果的定量分析:
[0022] 将检测样品实时荧光定量PCR获得的Ct值代入标准曲线方程y=-2.661x+44.459,进行活菌数计算,其中y为Ct值,x代表检测样品中梨火疫病菌活菌数的对数值。
[0023] 优选地,步骤(1)具体为:
[0024] 流水冲洗检测样品后,分别使用75%乙醇、1%次氯酸钠对检测样品进行表面消毒处理,无菌水清洗2-3次;
[0025] 在无菌条件下,将表面消毒后的检测样品剪碎,加入无菌水浸泡1-2h;
[0026] 吸取浸泡液,10000-13000r/min离心12-16min,弃去上清,加入无菌水悬浮沉淀。
[0027] 本发明对检测样品的处理简单、快速,并保证了后续检测结果的灵敏度、准确性。
[0028] 优选地,表面消毒后的检测样品剪成0.2cm左右的小段或1.0mm3左右的组织块。
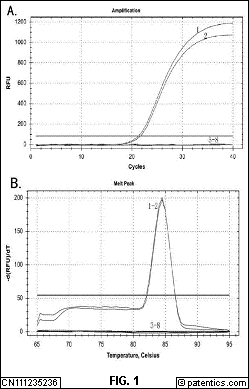
[0029] 优选地,步骤(2)具体为:
[0030] 避光条件下,向样品悬浮液中加入叠氮溴化丙锭,使叠氮溴化丙锭终浓度为25μmol/mL;避光振荡混匀后,在暗室摇床上110-130r/min振荡孵育8-12min;
[0031] 将孵育后的混合液转移至灭菌玻璃杜氏发酵管中,塞上灭菌胶塞,平置于加有冰水的不透光容器中,容器固定于暗室摇床上,振荡速度110-130r/min,并在玻璃杜氏发酵管上方15-20cm处挂置650W卤钨灯,连续照射曝光10-15min。
[0032] 优选地,不透光的容器可选择用锡纸严密包裹的容器,锡纸反光性好,可使曝光更为充分。
[0033] 现有技术中检测样品均盛放在离心管中进行卤钨灯曝光处理,但离心管透光性较差,卤钨灯光线不能充分穿透菌体,残留的PMA也不能充分的光解。卤钨灯曝光处理时会发热,温度过高会导致活菌死亡,造成假阳性现象,直接影响检测结果的准确性。本发明选用透光度好的玻璃杜氏发酵管盛装检测样品,同时将盛有检测样品的杜氏发酵管水平置于加冰水的不透光容器中,摇床振荡下曝光处理,保证了曝光充分,使死菌DNA与PMA的紧密结合,提高了样品检测的准确性。
[0034] 优选地,摇床振荡速度为120r/min,卤钨灯照射时间为10min。
[0035] 优选地,步骤(3)中,
[0036] 扩增反应体系为25μL:TB GreenTM Premix DimerEraser 12.5μL,10μmol/L上游引物EaP29F1 0.5μL,10μmol/L下游引物EaP29R1 0.5μL,ROX 0.5μL,模板为2.0μL,灭菌超纯水补足至25μL;
[0037] 扩增反应程序为:95℃预变性5min;95℃变性3s,54℃退火30s,72℃延伸30s进行40个循环,采集荧光。
[0038] 优选地,步骤(3)中,分别以经步骤(2)处理的梨火疫病菌活菌菌悬液和死菌菌悬液为模板,作为阳性对照和阴性对照;以灭菌超纯水为模板作为空白对照。
[0039] 优选地,在阴性对照未检出或Ct值≥35,并且空白对照未检出的前提下,
[0040] 当检测样品Ct值<35,判定为阳性;当Ct值≥35,判定为阴性。
[0041] 上述方法可应用于梨火疫病感病果树枝条、叶片、花、果实等样品中梨火疫病菌活菌的定性、定量检测。
[0042] 由上述技术方案可知,本发明的有益效果为:
[0043] 以检测样品中梨火疫病菌活菌为检测靶标,灵敏、准确地获取病原菌活体菌数量。掌握具有侵染力的病原菌活菌信息,对于病害的诊断和检疫,疫情的监测预警,研究掌握病原菌的侵染源、传播途径和流行规律,制定综合防控技术措施都具有重要的意义。
[0044] 对于果树的叶片、枝条、果实等样品,不需提取其中的DNA,用样品浸泡液直接进行PMA处理及扩增,整个检测过程仅需3-4个小时就能完成;检测简便、快捷,检测结果能定性和定量地直接反映样品带菌的真实状况。
[0045] 图1所示为引物对EaP29F1/EaP29R1的qPCR检测特异性分析结果;
[0046] 其中,图1-A为特异性检测不同菌株的扩增曲线;
[0047] 图1-B为特异性检测不同菌株的溶解曲线;
[0048] 图中1-2分别代表梨火疫病菌(E.a 0001)、梨火疫病菌(E.a 0017),3-6分别代表根癌农杆菌(Agrobacterium tumefaciens)、胡萝卜软腐菌(Erwinia carotovora var.)、草生欧文氏菌(Erwinia herbicola)、丁香假单胞菌(Pseudomonas syringae),7代表灭菌超纯水为空白对照,8代表健康梨树总DNA阴性对照。
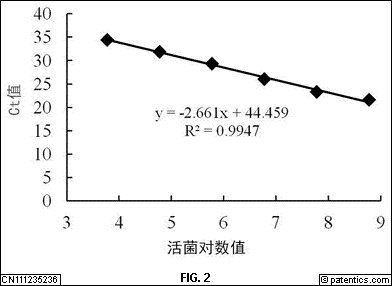
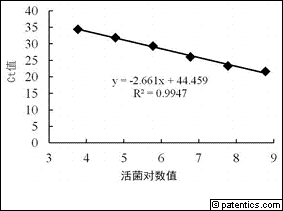
[0049] 图2所示为PMA-qPCR检测梨火疫病菌活菌的标准曲线。
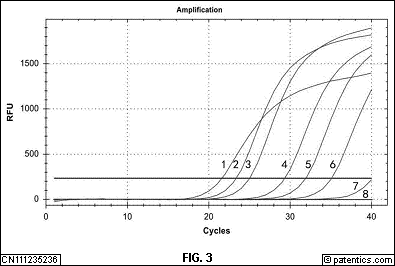
[0050] 图3所示为PMA-qPCR检测梨火疫病菌活菌的灵敏度;
[0051] 图中曲线1-7分别对应采用的活菌菌悬液模板浓度为6.0×108cfu/mL、6.0×107cfu/mL、6.0×106cfu/mL、6.0×105cfu/mL、6.0×104cfu/mL、6.0×103cfu/mL、6.0×102cfu/mL时的扩增情况,曲线8是灭菌超纯水空白对照。
[0052] 下面对本发明实施例中的技术方案进行清楚、完整地描述,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
[0053] 试验药品:TB GreenTM Premix DimerEraser(TaKaRa)购自宝日医生物技术(北京)有限公司。叠氮溴化丙锭(PMA)购自美国Biotium公司。
[0054] 仪器设备:实时荧光定量PCR仪(CFX96)美国BIO-RAD公司。
[0055] 供试菌株:梨火疫病菌(Erwinia amylovora)E.a 0001、E.a 0017来源于吉尔吉斯斯坦,由新疆乌鲁木齐市海关技术中心提供。根癌农杆菌(Agrobacterium tumefaciens)、胡萝卜软腐菌(Erwinia carotovora var.)、草生欧文氏菌(Erwinia herbicola)、丁香假单胞菌(Pseudomonas syringae)由新疆农业大学农学院微生物实验室提供。
[0056] 本发明中选用的所有试剂和仪器都为本领域熟知选用的,但不限制本发明的实施,其他本领域熟知的一些试剂和设备都可适用于本发明以下实施方式的实施。
[0057] 实施例1梨火疫病菌活菌PMA-qPCR检测方法的建立与优化
[0058] 1.引物的设计、合成与特异性验证
[0059](1)引物的设计与合成:
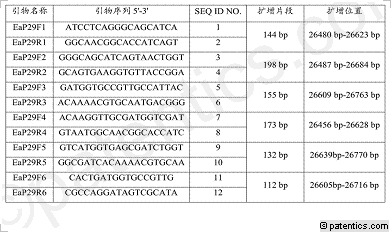
[0060] 本发明根据梨火疫病菌致病质粒pEA29(GeneBank登录号:HG813239)上的保守基因序列,设计了多组特异性引物(表1),并采用在线同源性比对,分析其序列特异性,结果表明本发明设计的引物区域为梨火疫病菌所特有,未发现除梨火疫病菌之外的可以和此对引物配对并引起扩增的物种,保证了扩增产物的特异性。引物由上海生工生物工程公司合成。
[0061] 表1梨火疫病菌特异性引物
[0062] 

[0063](2)引物的特异性验证:
[0064] 以梨火疫病菌(E.a 0001)、梨火疫病菌(E.a 0017)、根癌农杆菌(Agrobacterium tumefaciens)、胡萝卜软腐菌(Erwinia carotovora var.)、草生欧文氏菌(Erwinia herbicola)、丁香假单胞菌(Pseudomonas syringae)的新鲜培养菌悬液为模板、灭菌超纯水为空白对照、健康梨树总DNA为阴性对照,分别以引物对EaP29F1/EaP29R1、EaP29F2/EaP29R2、EaP29F3/EaP29R3、EaP29F4/EaP29R4、EaP29F5/EaP29R5、EaP29F6/EaP29R6进行梨火疫病菌的qPCR特异性检测。
[0065] 荧光定量PCR反应体系为25μL:TB GreenTM Premix DimerEraser 12.5μL,10μmol/L的上游引物0.5μL,10μmol/L的下游引物0.5μL,ROX为0.5μL,模板2μL,灭菌超纯水补足至25μL。
[0066] 反应程序:95℃预变性5min;95℃变性3s,54℃退火30s,72℃延伸30s,进行40个循环,收集荧光。
[0067] 特异性实验结果表明,本发明提供的6对引物均仅能扩增出梨火疫病菌,而其他的近缘种、属细菌及阴性对照均无扩增曲线。但以引物对EaP29F2/EaP29R2、EaP29F3/EaP29R3、EaP29F4/EaP29R4、EaP29F5/EaP29R5、EaP29F6/EaP29R6扩增的空白对照在Ct值>35后均出现非特异性扩增曲线,对反应产物进行溶解曲线分析显示,这5对引物的溶解曲线均出现双峰,说明这5对引物的扩增产物中有引物二聚体或非特异性扩增产物产生。而引物对EaP29F1/EaP29R1除可以特异性检测梨火疫病菌外(图1A),对反应产物进行溶解曲线分析(图1B)显示,当Tm值在84.50℃呈单一溶解峰,无引物二聚体和非特异性扩增,说明引物特异性良好。因此本发明优选EaP29F1/EaP29R1为PMA-qPCR特异性扩增引物。
[0068] 2.PMA预处理样品悬浮液条件的优化
[0069](1)PMA浓度优化:
[0070] 使用灭菌超纯水配置2.5mmol/mL的PMA工作液。取5份梨火疫病菌E.a 0001的新鲜活菌菌悬液(浓度为1×108cfu/mL)和5份梨火疫病菌E.a 0001的热灭活死菌菌悬液(加热灭活浓度为1×108cfu/mL活体菌悬液)各300μL加入离心管中。避光条件下在离心管中加入PMA工作液,使PMA终浓度分别为8μmoL/mL、17μmoL/mL、25μmoL/mL、34μmoL/mL和42μmoL/mL,将反应离心管用锡纸严密包裹,在涡旋仪充分震荡混匀后,在暗室摇床上120r/min振荡孵育10min。将离心管中的混合液全部转移至灭菌玻璃杜氏发酵管中,塞上灭菌胶塞后平置于用锡纸严密包裹并加有冰水的塑料保鲜盒中,保鲜盒固定于暗室摇床中,120r/min振荡,并在玻璃杜氏发酵管上方15cm处挂置650W卤钨灯,连续照射曝光10min。
[0071] 卤钨灯照射后,以各组菌悬液作为模板进行PMA-qPCR扩增,PCR反应体系(25μL):TB GreenTM Premix DimerEraser 12.5μL,10μmol/L的上游引物EaP29F1 0.5μL,10μmol/L的下游引物EaP29R1 0.5μL,ROX为0.5μL,模板2μL,灭菌超纯水补足至25μL。
[0072] 反应程序:95℃预变性5min;95℃变性3s,54℃退火30s,72℃延伸30s,进行40个循环,收集荧光。
[0073] 使用SPSS22.0统计分析实验所得数据:
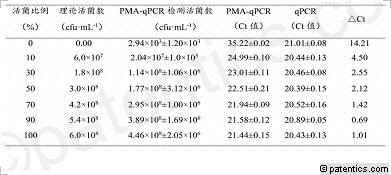
[0074] 当PMA浓度<25μmoL/mL时,死菌扩增的Ct值随PMA浓度增加而增大,说明低浓度的PMA不能完全与死菌DNA结合,不能充分抑制死菌DNA的扩增;而当PMA浓度≥25μmoL/mL时,随PMA浓度增大Ct值无显著变化(P>0.05),表明PMA浓度为25μmoL/mL可对死体菌DNA扩增最大限度地抑制。
[0075] 同时PMA对活菌的影响结果表明,当PMA浓度在0-25μmoL/mL范围时,各个浓度的Ct值无显著差异,但当PMA浓度>25μmoL/mL时,Ct值略有增加。因此,选择25μmoL/mLPMA作为预处理最佳浓度。
[0076](2)卤钨灯曝光时间优化:
[0077] 取6份梨火疫病菌E.a 0001的新鲜活菌菌悬液(浓度为1×108cfu/mL)和6份梨火疫病菌E.a 0001的热灭活死菌菌悬液(加热灭活浓度为1×108cfu/mL活体菌悬液)各300μL,分别加入2.5mmol/mL的PMA工作液,使其终浓度为25μmoL/mL,在距离650W卤钨灯下15cm处,分别曝光0min,5min,7min,10min,12min,15min。
[0078] 卤钨灯照射后,以各组菌悬液作为模板进行PMA-qPCR扩增,PCR反应体系(25μL):TB GreenTM Premix DimerEraser 12.5μL,10μmol/L的上游引物EaP29F1 0.5μL,10μmol/L的下游引物EaP29R1 0.5μL,ROX为0.5μL,模板2μL,灭菌超纯水补足至25μL。
[0079] 反应程序:95℃预变性5min;95℃变性3s,54℃退火30s,72℃延伸30s,进行40个循环,收集荧光。
[0080] 使用SPSS22.0统计分析实验所得数据:
[0081] 随着曝光时间的增长,活菌处理的Ct值无明显变化,但死菌处理的Ct值逐渐增大,当曝光时间≥10min时,死菌处理各个曝光时间的Ct值无显著差异(P>0.05),因此确定最优曝光时间为10min。
[0082] 实施例2 PMA-qPCR检测方法的灵敏性分析及标准曲线的建立
[0083] 在实施例1优化条件的基础上,用终浓度25μmol/mL的PMA处理浓度为6.0×108cfu/mL梨火疫病菌新鲜培养液,650W卤钨灯下曝光10min后进行10倍梯度稀释,稀释菌悬液中的活细胞数分别为6.0×108cfu/mL、6.0×107cfu/mL、6.0×106cfu/mL、6.0×105cfu/mL、6.0×104cfu/mL、6.0×103cfu/mL、6.0×102cfu/mL,取各组稀释菌悬液2μL为模板,进行PMA-qPCR检测,得到扩增动力学曲线与相应的标准曲线,根据测得的最低活菌数评价其灵敏性。
[0084] 以活菌数的对数值为横坐标,Ct值为纵坐标建立标准曲线(图2),获得标准曲线方程为y=-2.661x+44.459,R2=0.9947。
[0085] 由灵敏性试验扩增曲线可知(图3),当检测体系中活体菌数量为12cfu/反应体系(活菌浓度6.0×103cfu/mL)时,PMA-qPCR的Ct值为34.61;当检测体系中活体菌数量为1.2cfu/反应体系(活菌浓度为6.0×102cfu/mL)时,Ct值>40,检测结果为阴性。因此确定PMA-qPCR检测的灵敏度下限为12cfu/反应体系(活菌浓度6.0×103cfu/mL)。
[0086] 根据检测出的最低活菌数,本发明设立检测结果的判定标准为:检测样品Ct值<35为阳性,即检测样品中含有梨火疫病菌活体菌;当Ct值≥35,判定为阴性,即检测样品中不含有梨火疫病菌活体菌。
[0087] 实施例3 PMA-qPCR对不同比例死活菌混合液的检测可靠性验证
[0088] 在实施例1优化条件的基础上,将热灭活死菌菌悬液和新鲜活菌菌悬液按照不同比例充分混匀,配制成活菌比例为0%、10%、30%、50%、70%、90%、100%的菌悬液,各取300μL加入PMA预处理后,取2μL菌悬液进行PMA-qPCR检测,另设置不加PMA处理的样品作为对照组。
[0089] 检测结束后,根据检测样品的Ct值,结合标准曲线方程,计算不同死/活菌混合体系中活菌的数量。同时取100μL新鲜活菌菌悬液按照不同稀释倍数涂布平板并计数,用以计算检测样品中的活菌数量。
[0090] PMA-qPCR对不同比例活/死菌的检测结果显示(表2):
[0091] 当样品全部为死菌时(活菌比例为0%),PMA-qPCR的Ct值>35,而不加PMA的普通qPCR的Ct值为21,差异极显著(P<0.01)。当样品中活体菌的比例为10%-100%时,随着活体菌比例的增加,普通qPCR Ct值无明显变化,而PMA-qPCR的Ct值逐渐减小,但均高于未经PMA处理过的普通qPCR。当活菌含量为100%时,PMA-qPCR检测的Ct值与未经PMA处理过的普通qPCR Ct值没有显著差异(P>0.01)。当活菌比例增加,△CT值也逐渐减小,与未经PMA处理过的普通qPCR结果相比,PMA-qPCR检测结果更接近样本中的理论活菌数,二者数值在同一个数量级,二者无显著性差异(P>0.05)。
[0092] 上述结果表明,对于死菌和活菌同时存在的混合液,采用PMA-qPCR检测能完全抑制混合液中死菌DNA的扩增,而对活菌DNA的扩增无影响并仅以活菌DNA为靶标进行选择性扩增,可以客观地反应样品中的活菌数,从而消除常规qPCR检测中由于死菌扩增造成的的假阳性。
[0093] 表2不同比例活菌的PMA-qPCR检测结果
[0094] 

[0095] 注:△Ct=PMA-qPCR(Ct值)-对照组qPCR(Ct值)。
[0096] 实施例4果树枝条样品中梨火疫病菌活菌的PMA-qPCR检测
[0097](1)果树枝条发病处理:
[0098] 采集香梨、杜梨、苹果的当年生幼嫩枝条截至30cm左右,使用70%的酒精消毒后,插入装有0.5%NaCl溶液的三角瓶中防腐保湿。用梨火疫病菌菌悬液(浓度为1×108cfu/mL)喷雾接种,将接种后的枝条置于人工气候箱中25℃70%空气湿度下培养,以无菌水喷雾为空白对照。
[0099](2)制备样品悬浮液:
[0100] 枝条发病后称取0.1g发病组织,自来水流水冲洗1min后,再用75%乙醇浸泡表面消毒30s,1%次氯酸钠浸泡表面消毒1min,无菌水清洗3次。
[0101] 检测样品清洗后,在无菌条件下将其剪碎成0.2cm小段,放入装有1mL无菌水的离心管中,浸泡1.5小时。吸取浸泡液至1.5mL灭菌离心管中,12000r/min离心15min,弃去上清,加入300μL无菌水悬浮沉淀,获得样品悬浮液。
[0102](3)PMA预处理样品悬浮液:
[0103] 避光条件下,向样品悬浮液中加入2.5mmol/mL的PMA工作液3μL,使其终浓度为25μmol/mL。使用锡纸严密包裹离心管,在涡旋仪充分震荡混匀后,置于暗室摇床上120r/min振荡孵育10min。
[0104] 孵育后将离心管中的混合液全部转移至灭菌玻璃杜氏发酵管中,塞上灭菌胶塞,平置于用锡纸严密包裹并加有冰水的塑料保鲜盒中,保鲜盒固定于暗室摇床中,120r/min振荡,并在玻璃杜氏发酵管上方15cm处挂置650W卤钨灯,连续照射曝光10min。
[0105](4)实时荧光定量PCR检测:
[0106] 经PMA预处理的样品悬浮液作为模板,进行实时荧光定量PCR扩增;
[0107] 扩增反应体系为25μL:TB GreenTM Premix DimerEraser 12.5μL,10μmol/L上游引物EaP29F1 0.5μL,10μmol/L下游引物EaP29R1 0.5μL,ROX 0.5μL,模板为2.0μL,灭菌超纯水补足至25μL;
[0108] 扩增反应程序为:95℃预变性5min;95℃变性3s,54℃退火30s,72℃延伸30s进行40个循环,采集荧光。
[0109] 以未接种病原菌的健康枝条为对照。同时采用平板培养计数法检测样品浸提液中的活菌数。
[0110] 检测结果显示(表3),人工接种发病的香梨、杜梨、苹果枝条中均能检测到梨火疫病菌活体菌,PMA-qPCR与平板培养计数测得的活菌数数值在同一数量级中,二者无显著差异(P>0.05),而对照组的检测结果为阴性。PMA-qPCR方法能准确定量检测出发病的植物组织中的E.a活菌,平板培养计数法验证了其结果的可靠性。
[0111] 表3 PMA-qPCR和平板培养计数法对三种果树枝条样品中E.a活菌的检测结果
[0112] 

[0113] 上述所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。